
淋巴细胞亚群中的T细胞、B细胞和自然杀伤(NK)细胞,即TBNK 淋巴细胞是机体重要的免疫细胞,检测其水平变化能提示机体免疫状态的改变。TBNK 淋巴细胞检测已全面应用于艾滋病、严重急性呼吸综合征(SARS)、慢性乙型肝炎、手足口病、Epstein-Barr 病毒(EBV)感染、流行性出血热等多种感染性疾病患者的免疫评估及诊治,也逐渐成为自身免疫病、肿瘤、器官移植、血液系统疾病、重症监护医疗、老年医学及保健等学科的免疫监测辅助工具。
国家卫健委于今年4月更新的《流式细胞术检测外周血淋巴细胞亚群指南》在仪器和项目检测的性能验证及质量控制这块做了大篇幅的更新,从而让TBNK的检测更加规范。而质量控制是结果准确发布的前提,因此做好TBNK的性能验证及质控为临床结果的准确发布保驾护航。今天我们一起来看一看指南的介绍。
仪器性能验证
01 验证时机
 新仪器启用前
新仪器启用前
 仪器搬移后
仪器搬移后
 仪器发生重大维修后(如更换激光、光纤、光电倍增管或流动室等)
仪器发生重大维修后(如更换激光、光纤、光电倍增管或流动室等)
 仪器软件系统更新后
仪器软件系统更新后
 仪器性能出现问题或环境严重失控时
仪器性能出现问题或环境严重失控时
02 验证项目
 灵敏度
灵敏度
散射光灵敏度:采用已知大小的校准微球检测仪器的FSC和SSC。在散射光FSC/SSC散点图上,应检测出直径0.5mm 或更小的微球,或满足仪器出厂声明的要求。
荧光灵敏度:流式细胞仪能检测到标准荧光微球上的最少荧光分子数, 可用MESF表示,常用荧光通道应为FITC≤ 200 MESF、PE≤100 MESF 、APC≤200 MESF,或满足仪器出厂声明的要求。
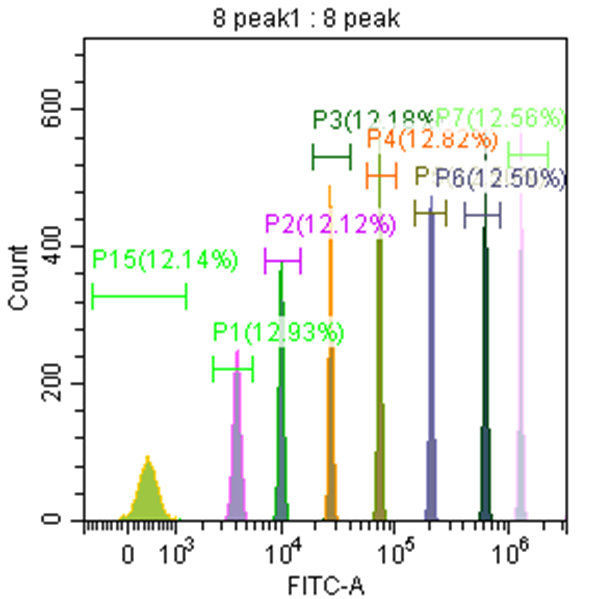
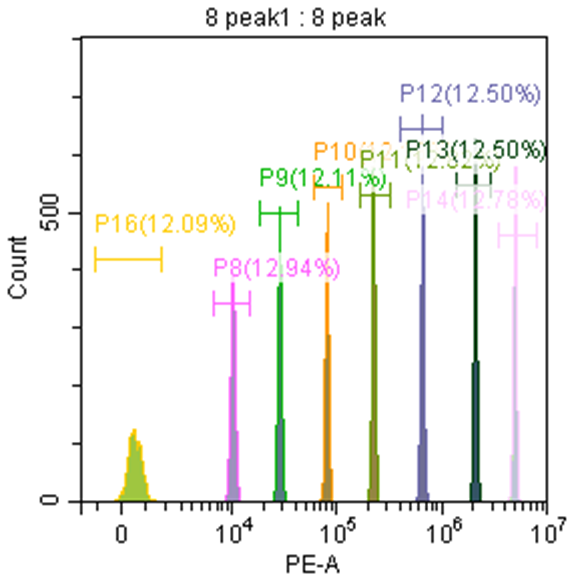
以8峰微球检测MESF举例,每个荧光通道获取8峰微球的MFI,根据微球说明书提供的软件,计算相对应荧光通道的MESF。
 分辨率
分辨率
散射光分辨率:采用EDTA盐或肝素抗凝全血,取适量样品稀释后直接上机测定,标本在FSC/SSC散点图可将红细胞和血小板清晰地区分开;取适量样品裂解红细胞后上机测定,标本在FSC/SSC散点图可将淋巴细胞、单核细胞、粒细胞清晰地区分开,即认为散射光分辨率符合要求。
荧光通道分辨率:采用校准微球上机测定,各荧光通道的分辨率CV值应符合制造商声明的要求。
 荧光通道线性
荧光通道线性
可采用含有不同荧光强度的校准微球(已知其相应荧光素的MESF)进行检测,计算每 一种荧光微球的MFI,以MEFL数(y)和平均荧光强度(x)的线性回归,计算相关系数(r)。相关系数r应≥0.98,此方法适用于校准微球上的荧光素可被定量检测的荧光通道。
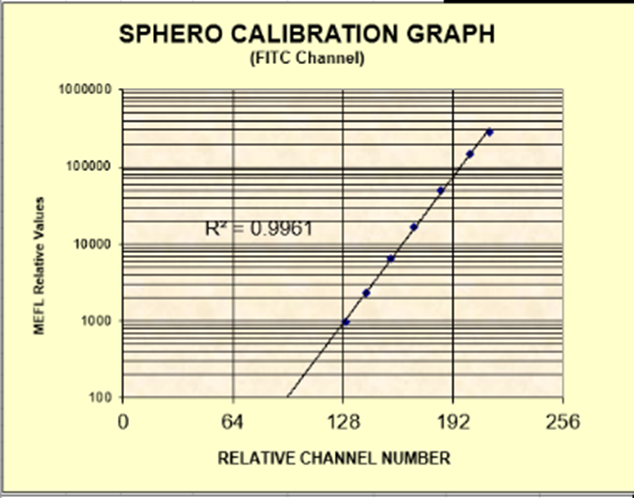
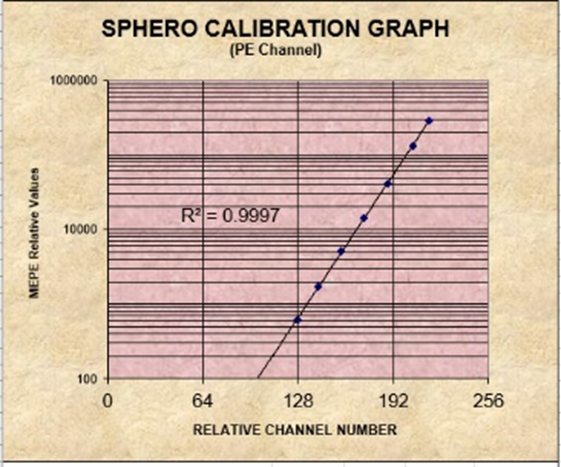
以FITC/PE通道8峰微球举例
 仪器稳定性
仪器稳定性
将标准微球充分混匀后上机进行试验,测试完成后利用直方图分析实验结果,计算标准微球的平均荧光强度FL1,连续8小时开机后,再通道条件下重复检测,得到标准微球的平均荧光强度FL2,根据两次检测结果计算偏差,公式见下,每一通道的平均荧光强度变化范围均应在基线值±10%范围内。

 携带污染率
携带污染率
使用浓度为5000个/µL~10000个/µL的校准微球上机进行测定,获取至少100000个颗粒,连续测定3 次,计算检测通道内设定区域的颗粒数,分别记为H1、H2、H3;再使用空白溶液上机测定,获取颗粒30s,连续测试3次,计算该检测通道内设定区域的颗粒数,分别记为L1、L2、L3。按照此步骤重复循环3 次。
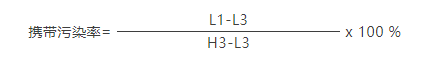
取上述公式计算最大值。携带污染率应≤0.5%。
TBNK 性能验证
01 验证时机
 项目开展初期
项目开展初期
 更换试剂品牌后
更换试剂品牌后
 更换检测系统后
更换检测系统后
 仪器的重大部件维修后
仪器的重大部件维修后
02 验证项目
 精密度
精密度
批内精密度:选取至少5个新鲜全血样品,样品的淋巴细胞亚群细胞计数应覆盖低中高水平。每个标品从荧光染 色到上机检测重复3次,并确保所有测试都在同一台仪器的同一批内测定,整个操作过程由同一个操作 人员完成。先计算每个样品重复3次后检测结果的CV,然后计算所有样品的平均CV,所有样品的平均CV 宜<10%,最大不超过20%。实验室可根据不同水平的淋巴细胞亚群细胞计数设定不同程度的可接受CV 标准。
日间精密度:宜使用正常和异常两个浓度水平的全血质控品,每天从荧光染色到上机测定重复操作3次, 至少重 复4天,整个操作过程可由不同操作人员完成。先计算每天每个全血质控品重复3次检测结果的CV值,然 后据此计算每个全血质控品4天的平均CV,最后得出两个全血质控品检测结果的平均CV。判定标准同上。
 稳定性
稳定性
样品稳定性:验证样品在确定的抗凝及处置条件下的稳定性。采集健康人或患者的样品至少 5 份,即刻染色-裂 解-固定并上机测定,以此结果作为基线参考水平,按照实验室的具体环境温度控制条件和预期的样品待检时间,在抗凝剂保存时间内,设置不同的时间点对上述样品进行重复处理和上机测定,获取检测结果,并与基线水平结果进行比较,以相对偏差或绝对偏差表示,检测结果应符合实验室制定的验证要求。淋巴细胞亚群计数过低者,宜以绝对偏差进行验证;亦可对试剂说明书声明的稳定性条件进行验证。
处理后标本稳定性:旨在明确处理后标本的最长待检时间。采集健康人或患者的样品至少5份,对完成染色-裂解-固定 后的标本即刻上机检测结果作为基线水平。按实验室获得检测结果的最长可接受时间为期限,设置不同 的时间点对固定后标本进行上机检测。结果判定同上一条。亦可对试剂说明书声明的稳 定性条件进行验证。
 线性范围
线性范围
适用于淋巴细胞亚群绝对细胞计数。根据试剂说明书声明的线性范围,取一份淋巴细胞计数或亚群 计数接近线性范围上限的临床样品,采用样品稀释液按照比例制备 5~9 个不同浓度的标本,浓度范围应覆盖临床医学决定水平;通过染色-裂解-固定后,上机测定, 每个标本重复测定 4 次,取均值。分析实际测定的亚群细胞数量均值与理论值之间的相关性,相关系数 r 应≥0.975。
 可比性
可比性
抗体试剂批次变更前后的可比性验证:宜使用至少3份健康人的新鲜全血样品和2份不同浓度质控品,采用新批号抗体试剂和当前批号抗体 试剂进行荧光染色、上机检测,以当前批号试剂检测结果为参考,计算相对偏差或绝对偏差。检测结果 应符合实验室制定的验证要求。验证要求的制定应考虑不同水平的淋巴细胞亚群计数设定不同程度的偏 差值,淋巴细胞亚群计数过低者,宜以绝对偏差进行验证。
不同检测系统间的可比性验证:宜使用至少 5 份新鲜全血样品(样品的淋巴细胞亚群细胞计数应覆盖低中高水平)和 2 份不同浓度 水平的全血质控品,完成染色-裂解-固定后,分别采用待评价检测系统和比对检测系统进行检测。比对 检测系统应为仪器性能良好、规范开展室内质量控制、室间质量评价成绩合格的淋巴细胞亚群常规检测 系统,以比对检测系统的测定结果为参考,计算相对偏差或绝对偏差。检测结果应符合实验室制定的验 证要求。验证要求的制定应考虑不同水平的淋巴细胞亚群计数设定不同程度的偏差值,淋巴细胞亚群计 数过低者,宜以绝对偏差进行验证。
不同检测人员间的可比性验证:宜使用至少5份新鲜全血样品和2份不同浓度水平的全血质控品,分别由实验室内淋巴细胞亚群检测 培训合格的不同检测人员完成染色-裂解-固定、上机检测和数据分析,计算不同检测人员间检测结果的 相对偏差或绝对偏差。验证结果应符合实验室制定的验证要求。
 准确度
准确度
可使用室间质评回报结果验证淋巴细胞亚群项目的准确度。
TBNK 室内质控
01 质控品选择
应首选商品化全血质控品进行室内质控,并至少包括两个浓度水平,CD4+T细胞的绝对细胞计数应包括低值浓度水平质控。
02 检测时间
检测当日至少做一次质控,质控品应和患者样品同时进行免疫荧光染色,并在患者标本检测前进行上机测定和数据分析。检测完成后做好相应质控记录。
03 靶值建立
 实验室应建立每一批次质控品的靶值和可接受范围,不可直接引用说明书提供的质控范围。
实验室应建立每一批次质控品的靶值和可接受范围,不可直接引用说明书提供的质控范围。
 更换新批号质控品前,可通过每日检测4次质控品(不同时间点),连续5天收集20次数据,计算均值。
更换新批号质控品前,可通过每日检测4次质控品(不同时间点),连续5天收集20次数据,计算均值。
 均值作为新批次靶值,结合既往累计CV值推算SD。
均值作为新批次靶值,结合既往累计CV值推算SD。
04 失控判断标准
应至少选择13S和22S作为失控判断标准,应有相应的失控纠正措施。
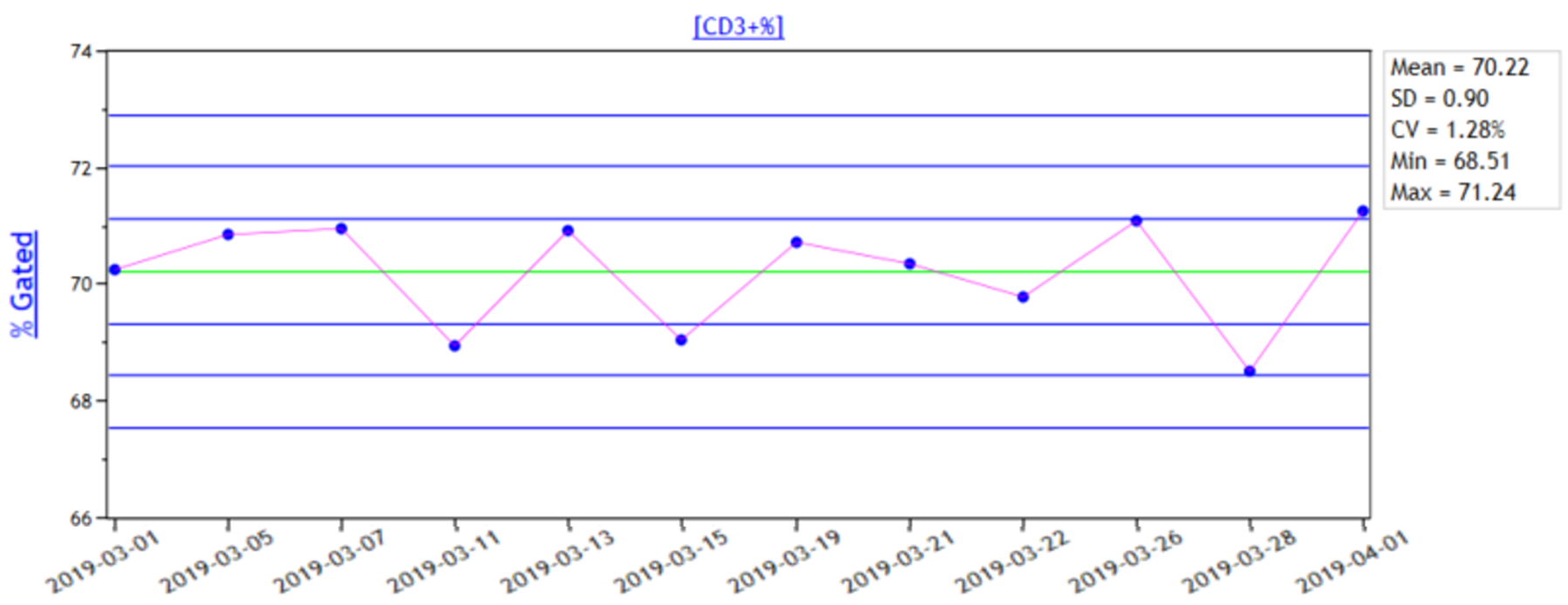
以CD3+T细胞质控曲线举例
随着TBNK项目开展的普及,结果的准确与患者免疫状态的评估和治疗方案的制订是否能够正常进行的前提与保障。因此TBNK室内质控尤为重要,可以确保TBNK检测结果的准确性和可靠性。
 如需进一步了解性能验证的内容以及质控品的介绍,可与贝克曼库尔特生命科学的技术支持和销售联系。
如需进一步了解性能验证的内容以及质控品的介绍,可与贝克曼库尔特生命科学的技术支持和销售联系。
● 参考文献:
1.中华医学会健康管理学分会,TBNK淋巴细胞检测在健康管理中的应用专家共识.中华健康管理学杂志,2023,17(02):85-95
2.WS/T360—2024,流式细胞术检测外周血淋巴细胞亚群指南
3.WS/T 406-2012 临床血液学检验常规项目分析质量要求
4. YY/T0588-2017 流式细胞仪
