
01研究背景
食管癌是一种高度恶性肿瘤,食管鳞状细胞癌(ESCC)是食管癌常见的组织学亚型,预后差,全球患病率高。RNA N6 -甲基腺苷(m6A)修饰与癌症进展有关,但其在癌症进展过程中调节长链非编码RNA的作用尚不清楚。在本研究中作者发现m6A去甲基化酶(FTO)稳定LINK-A,以促进ESCC的细胞增殖和化疗耐药,并确定FTO/LINK-A/MCM3/HIF-1α轴是ESCC的一个有希望的治疗靶点。
02部分结果展示
1. LINK-A在ESCC中发挥致癌作用
作者发现FTO与ESCC的化学耐药相关,并能稳定LINK-A。为了研究LINK-A在ESCC中的作用,作者利用原位杂交分析ESCC患者中LINK-A的表达,发现LINK-A在癌组织中的表达明显高于正常组织并与预后不良密切相关。体外和体内功能丧失和获得实验发现沉默LINK-A可显著抑制化疗耐药和亲本ESCC细胞系的细胞增殖,而过表达LINK-A则可促进细胞增殖;异种移植实验表明,在KYSE450/DDP和KYSE450细胞中沉默LINK-A可显著延缓肿瘤生长并引起化疗敏感性,而在KYSE150细胞中过表达LINK-A可显著促进肿瘤生长并对化疗产生耐药性。这些结果表明LINK-A在ESCC中发挥致癌作用。
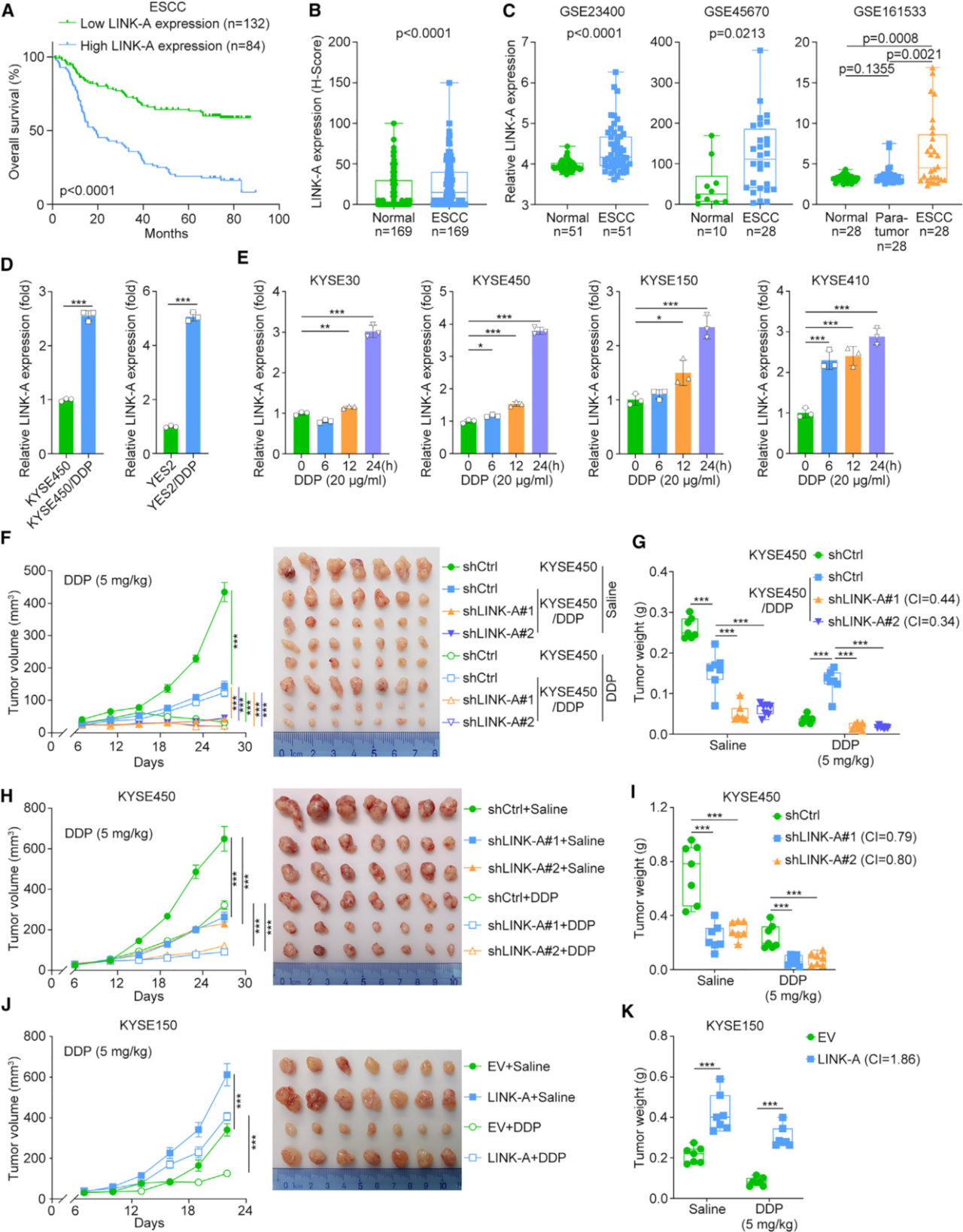
图1. LINK-A在ESCC中发挥致癌作用
2. LINK-A通过促进MCM3与CDK1的相互作用促进MCM3磷酸化
为了探究LINK-A的致癌机制,作者进行了质谱、RNA下拉、RIP-qPCR等实验,发现MCM3与LINK-A存在特异性相互作用,WB分析表明,LINK-A显著促进了MCM3在Ser112位点的磷酸化。有研究表明,CDK1磷酸化MCM3的Ser112位点,并介导MCM2-7复合物的组装和染色质装载。RNA下拉和WB的结果证实了LINK-A和CDK1之间的相互作用, coIP实验发现过表达LINK-A促进CDK1和MCM3之间的相互作用。这些结果表明LINK-A通过促进MCM3与CDK1的相互作用促进MCM3磷酸化。进一步研究发现MCM3磷酸化促进MCM2-7复合物的组装和染色质装载以及细胞周期进程和细胞增殖。此外,LINK-A消除MCM3介导的HIF-1α转录抑制来激活HIF-1α,从而促进了肿瘤代谢重编程和化疗耐药。
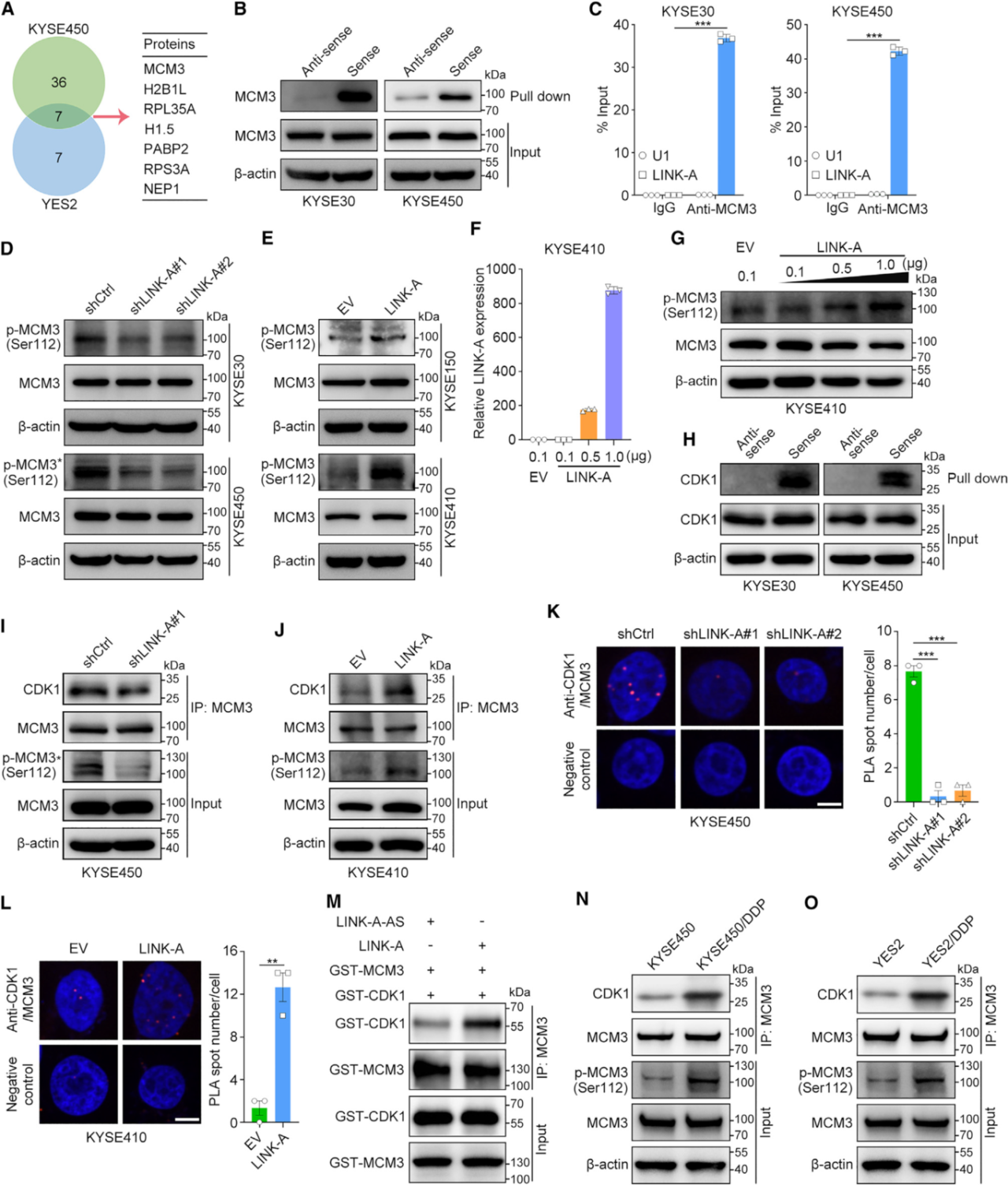
图2. LINK-A通过促进MCM3与CDK1的相互作用促进MCM3磷酸化
3. 靶向LINK-A使ESCC对细胞毒性化疗敏感
为了确定靶向LINK-A是否是ESCC的有希望的治疗策略,作者建立了异种移植小鼠模型,发现AAV介导的LINK-A沉默显著增加了ESCC异种移植的DDP敏感性。同时与化疗敏感组相比,化疗耐药组中LINK-A的表达水平显著上调,且样本中LINK-A的表达与FTO的表达呈正相关,这进一步证实了FTO在ESCC化疗耐药过程中对LINK-A的调控作用。这些结果表明LINK-A是ESCC化疗耐药的罪魁祸首,并揭示了LINK-A介导的化疗耐药的潜在机制以及LINK-A在ESCC中的稳定性调控。
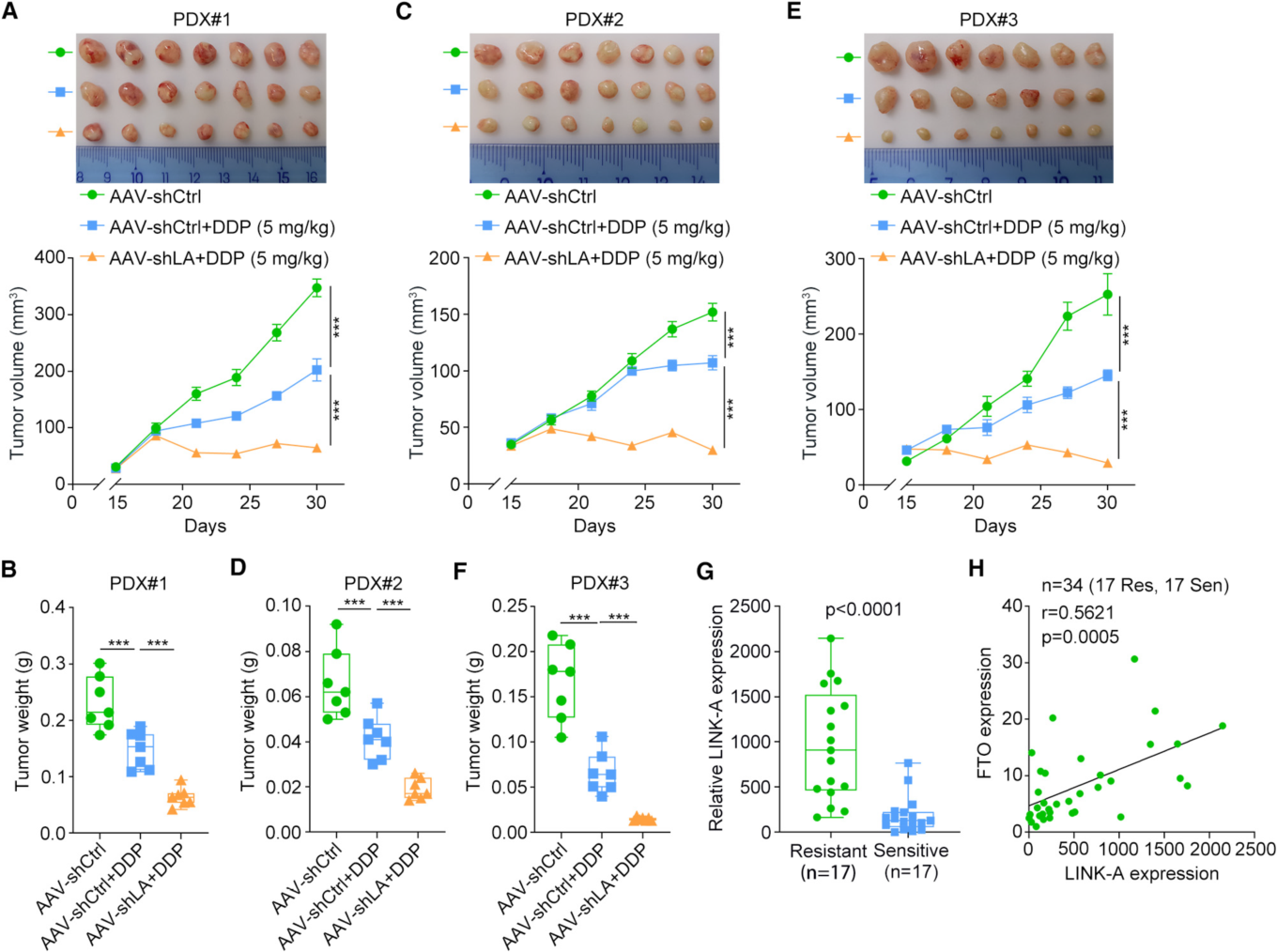
图3. 靶向LINK-A使ESCC对细胞毒性化疗敏感
03实验结论
本研究阐明了LINK-A致癌的机制,LINK-A促进 MCM3的磷酸化,导致MCM复合物装载到染色质上,从而促进细胞周期进程和随后的细胞增殖;此外,LINK-A破坏MCM3与HIF-1α之间的相互作用,消除MCM3介导的HIF-1α转录抑制,促进肿瘤代谢重编程和化疗耐药。本研究表明了FTO/LINK-A/MCM3/HIF-1α轴是ESCC的一个有希望的治疗靶点。
