理性阐述qPCR实验的Ct值的合理范围。(附Ct值过大或过小的解决方法)
Ct值是什么?
Ct值具有什么样的作用?
Ct值的正常范围是多少?
Ct值太大或者太小的原因?
Ct值是荧光定量PCR最重要的结果呈现形式。它被用于计算基因表达量差异或者基因拷贝数。那么荧光定量的Ct值多大可被认为是合理?如何保证Ct值的有效范围呢?今天就让小编来为大家解答这个问题。
Ct值是什么?
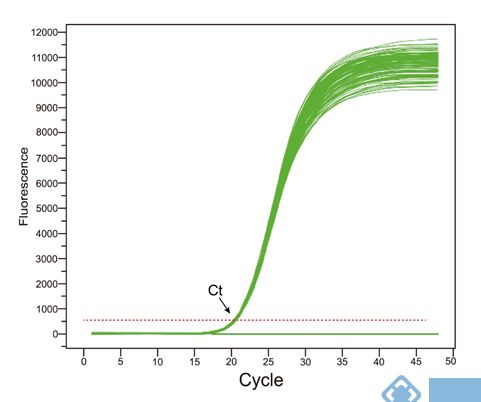
qPCR扩增过程中,扩增产物的荧光信号达到设定的荧光阈值时的所对应的扩增循环数(Cycle Threshold)。C代表Cycle,T代表Threshold。简单讲,Ct值就是qPCR中起始模板扩增达到一定产物量时,所对应的循环数。所谓“一定产物量”后续作进一步解释。
Ct值有什么作用?
1.指数扩增、模板量与Ct值的关系
理想情况下,qPCR中的基因经过一定的循环数被指数扩增而积累,扩增循环数和产物量之间的关系是:扩增产物量=起始模板量×(1+En)循环个数。然而qPCR反应并不是一直处于理想情况下,当扩增产物量达到“一定产物量”时,此时循环个数为Ct值,处于指数扩增时期。Ct值与起始模板量的关系:模板的Ct值与该模板的起始拷贝数的对数存在线性关系。起始模板量浓度越高,Ct值越小;起始模板量浓度越低,Ct值越大。
2.扩增曲线、荧光阈值与一定产物量
qPCR扩增产物量是以荧光信号的形式直接呈现,也就是扩增曲线。在PCR早期,扩增处于理想情况下,循环数较少,产物积累少,产生荧光的水平不能与荧光本底背景明显地区别,之后荧光的产生增加进入指数期。可以在PCR反应刚处于指数期的某一点上来检测PCR产物的量,以此作为“一定产物量”,并且由此来推断模板最初的含量。因此,一定产物量对应的荧光信号强度,也就是荧光阈值。
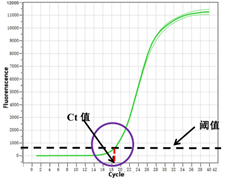
在PCR的后期,扩增曲线不再呈现指数扩增,进入线性期和平台期。
3.Ct值的重现性
PCR循环在到达Ct值所在的循环数时,刚刚进入真正的指数扩增期,此时微小误差尚未放大,因此Ct值的重现性极好,即同一模板不同时间扩增或同一时间不同管内扩增,得到的Ct值是恒定的。
Ct值的范围?
1.扩增效率En
PCR扩增效率是指聚合酶把待扩增基因转变生成扩增子的效率。由1个DNA分子转变生成2个DNA分子时的扩增效率为100%。扩增效率常用En表示。为了方便后续文章的分析,简要介绍下影响扩增效率的因素。
|
影响因素 |
解释 |
如何判定? |
|
A.PCR抑制剂 |
1.模板RNA中可能含有抑制PCR反应的物质,如蛋白质或去污剂等。 2.反转录后的cDNA中含有高浓度的模板RNA和反转录试剂成分,也可能对后续PCR存在抑制。 |
1.可通过测定A260/A280和A260/A230比值或RNA电泳,判断是否存在污染。 2.反转录后cDNA是否按照一定比例进行稀释。 |
|
B.引物设计不合理 |
引物不能有效退火 |
检查引物是否存在二聚体或发夹结构、存在错配;有时需注意跨内含子设计。 |
|
C.反应程序不合适 |
1.引物不能有效退火。 2.DNA聚合酶活性未充分释放, 3.长期高温,DNA聚合酶活性下降。 |
1.退火温度高于引物Tm值。 2.预变性时间太短。 3.反应程序各阶段时间过长。 |
|
D.试剂未充分混匀或移液误差 |
反应体系中,PCR反应成分的局部浓度过高或不均匀,导致PCR扩增不呈指数扩增。 |
|
|
E.扩增子长度 |
扩增子长度太长,超过300bp,扩增效率低。 |
检查扩增子长度是否在80bp-300bp之间。 |
|
F.qPCR试剂的影响 |
试剂中DNA聚合酶浓度较低或Buffer中离子浓度非最优化,导致Taq酶活力未达最强。 |
标准曲线测定引物扩增效率。 |
2.Ct值的范围
Ct值的范围为15-35。Ct值小于15,认为扩增在基线期范围内,未达到荧光阈值。理想情况下,Ct值与模板起始拷贝数的对数存在线性关系,也就是标准曲线。通过标准曲线,扩增效率为100%时,计算出基因单个拷贝数定量的Ct值在35左右,若大于35,理论上模板起始拷贝数小于1,可认为无意义。

对于不同的基因Ct范围,因起始模板量中基因拷贝数和扩增效率不同,需做出该基因的标准曲线,计算出基因的线性检测范围。
3.Ct值的影响因素
由扩增循环数和产物量之间的关系:扩增产物量=起始模板量×(1+En)循环个数,可以看出,在理想条件下,起始模板量和En会对Ct值产生影响。模板质量或者扩增效率的差异会造成Ct值偏大或过小。
4.Ct值过大或过小
小翊威逼利诱了我公司技术部的牛牛们,总结出Ct值常见的两类问题的原因和解决方法,以飨读者。
|
问题 |
可能的原因 |
解决方法 |
|
Ct值过大 |
1.模板浓度低或存在PCR抑制物 2.扩增效率低 |
1.提高模板浓度;或提高RNA或cDNA稀释比例;或重新制备模板。 2.降低退火温度,或选用二步法扩增;组分和体系充分混匀;优化反应程序;或尝试更换试剂。 |
|
Ct值过小 |
1.模板浓度高 2.NTC和NRC存在污染 3.引物设计不合适 |
1.减少模板RNA量;或更高比例稀释cDNA。 2.重新更换所有试剂;或使用UDGase防污染试剂。 3.优化程序,避免非特性扩增。 |
附翊圣高效定量产品:
