在上期的“基因编辑探秘系列之原理篇”中,小翌已经详细介绍了CRISPR系统的分类、机制和原理。本篇文章将为大家介绍CRISPR技术的生物形式和递送技术。
CRISPR技术的生物形式
为了实现基因组编辑,CRISPR/Cas系统的组件需要进入靶细胞的细胞核中发挥作用,可以通过递送不同形式的Cas和向导RNA(gRNA)来实现,包括质粒DNA(pDNA),mRNA或Cas核糖核蛋白(RNP)三种生物形式。
01
pDNA形式
pDNA通常被用作非病毒DNA传递的载体,其介导的CRISPR技术是将Cas9蛋白和gRNA的基因序列融入单个或多个pDNA载体之中。因pDNA具有易构建、操作简便以及成本效益高等优点,成为了备受瞩目的基因编辑方法。目前广泛应用的Cas9质粒包含两个表达盒,一个是密码子优化的Cas9,一个是嵌合的gRNA。与我们细胞内遗传信息的流动一致,含有CRISPR系统元件的pDNA需先进入细胞核,随后转录成相应的mRNA,最后被转移到细胞质中以启动后续的蛋白质合成过程。
02
mRNA形式
mRNA介导的CRISPR基因编辑技术,其核心在于将Cas9 mRNA与gRNA共同精准地递送至靶细胞。相较于传统的pDNA转染方式,mRNA的递送方式能够更为迅速地启动蛋白质表达过程。与pDNA的应用策略不同,基于mRNA的编辑策略要求同时递送Cas9 mRNA和gRNA这两种关键的组分。Cas9 mRNA的制备主要依赖于体外转录(IVT)技术,并经过加帽和加尾修饰,以确保其稳定性和翻译效率。gRNA作为另一重要组件,存在双链和单链两种形式。双链形式的gRNA由crRNA和tracrRNA共同构成,这两部分需要通过退火过程形成稳定的复合物。在实际应用中,可以通过化学合成的方式分别制备crRNA和tracrRNA,进而组装成完整的双链gRNA。而单链形式的gRNA则是将crRNA和tracrRNA巧妙地融合成一个单一的分子,无需退火过程。单链gRNA可以通IVT或化学合成的方式获得,两种方法各有利弊,可根据实验需求进行灵活选择。
IVT作为一种广泛应用的gRNA生产方法,因其成本效益高、产量大以及操作简便等优点,在实验室中得到了广泛的推广和应用。化学合成gRNA是利用高通量化学合成平台来完成的,通过在gRNA的5’和3’端各加入3个硫代和甲氧基修饰,不仅可以提高gRNA的稳定性,还能有效降低脱靶效应,从而提高基因编辑的精确性和安全性。
03
RNP形式
在CRISPR/Cas系统的应用中,直接递送Cas9蛋白与gRNA,从而绕过pDNA或mRNA在细胞内部的转录与翻译过程,无疑是实现高效基因编辑的优选方法。这种基于蛋白的递送方式同样依赖于两个核心成分:Cas9核酸酶与gRNA,首先将Cas9蛋白与gRNA结合,形成带有负电荷的Cas9/gRNA核糖核蛋白(Cas9 RNP)复合物,随后将Cas9 RNP作为单一组分进行递送。这种技术不仅简化了操作过程,更提高了基因编辑的效率和准确性。
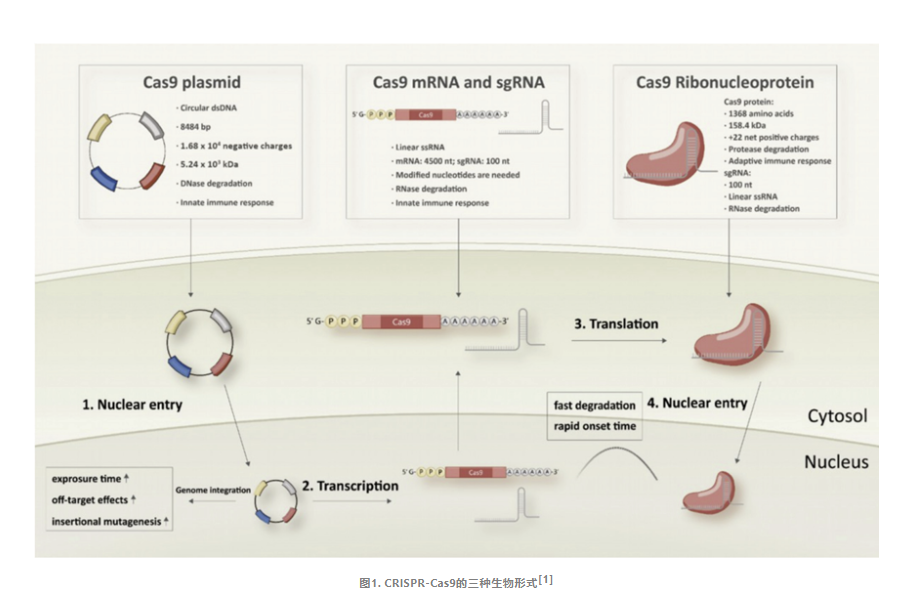
三种生物形式的差异
每种CRISPR系统的生物形式都有其独特的物理、化学、生理特性。
01
稳定性
Cas9 pDNA表现出最高的稳定性,相比之下,mRNA的稳定性较差,可通过对其核苷酸进行化学修饰提升mRNA的稳定性。Cas9 RNP由蛋白质和gRNA组成,其结构使得它容易受到蛋白酶和RNases的降解,因此是最不稳定的形式。
02
递送方式
当Cas9的pDNA进入细胞后,它需经过转录和翻译的过程,最终产生Cas9蛋白。而Cas9的mRNA则更为直接,仅需被传递至细胞质中,便可启动翻译过程生成Cas9蛋白。随后Cas9蛋白与gRNA组装为复合体发挥编辑作用。相较之下,RNP形式能够直接入核进行编辑,无需经历上述复杂的转录和翻译过程。因此,递送Cas9 RNP成为了细胞基因组编辑中最为直接且高效的策略,通常也被认为是最为理想的编辑方法。
03
脱靶风险
在基因组编辑应用中,CRISPR/Cas复合物仅在基因组修饰发生期间暂时需要,其在细胞中过度存在会增加脱靶事件的风险。Cas9 RNP和mRNA在细胞内的存在时间相对较短,有助于降低脱靶效应的潜在风险。而Cas9 pDNA能够介导更长时间的基因表达,可能会增加脱靶编辑事件发生的风险。
04
Cas蛋白尺寸
由于常用的Cas9, Cas12a和Cas13a大小接近4kb, 而用于递送基因编辑器到体内的AAV系统的包装上限约为4.7 kb,因此寻找更小的基因编辑系统对于其高效体内递送具有重要意义。目前不同的Cas系统均有小型Cas蛋白被开发,如Cas9系统中来自金黄色酿脓葡萄球菌中的SaCas9(1000多个氨基酸);Cas12系统中的AaCas12b和BhCas12b(1100多个氨基酸);Cas14(又称Cas12f1,500个氨基酸) 、Cas12j(又称CasΦ,700氨基酸);Cas13系统中的Cas13bt(~800氨基酸),基因编辑已进入迷你时代。
CRISPR/Cas系统常见的三种应用模式pDNA、mRNA和RNP各有优缺点。从张锋、刘如谦的最新发文来看,未来RNP形式的蛋白递送或将成为继mRNA之后的下一个焦点。
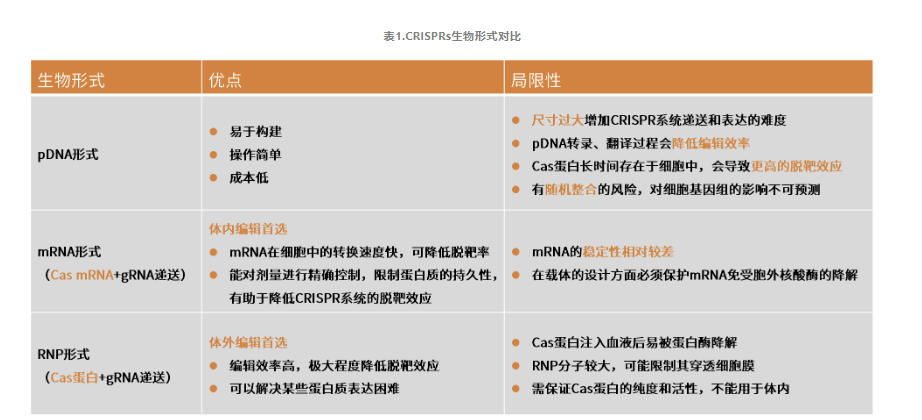
CRISPR系统的三种递送技术
CRISPR系统的生物形式各异,因此其递送方法也呈现出多样性。目前,CRISPR/Cas9系统的递送策略已发展出多种方法,主要分为三大类别:生物递送方法、化学递送方法以及物理递送方法。
在生物递送方法中,常利用腺相关病毒(AAV)载体、慢病毒载体等作为传递CRISPR/Cas9系统的媒介,这些载体具有生物相容性好、转染效率高等优点,被广泛应用于基因编辑领域。
化学递送方法则主要依赖脂质纳米颗粒(LNP)等纳米材料作为载体,它们能够高效地封装CRISPR/Cas9系统并将其递送至细胞内,同时具有较高的靶向性和生物安全性。
物理递送方法则包括电穿孔、显微注射等技术,这些方法通过物理手段将CRISPR/Cas9系统直接导入细胞内部,虽然操作复杂且对细胞损伤较大,但在某些特定应用场景下仍具有独特的优势。
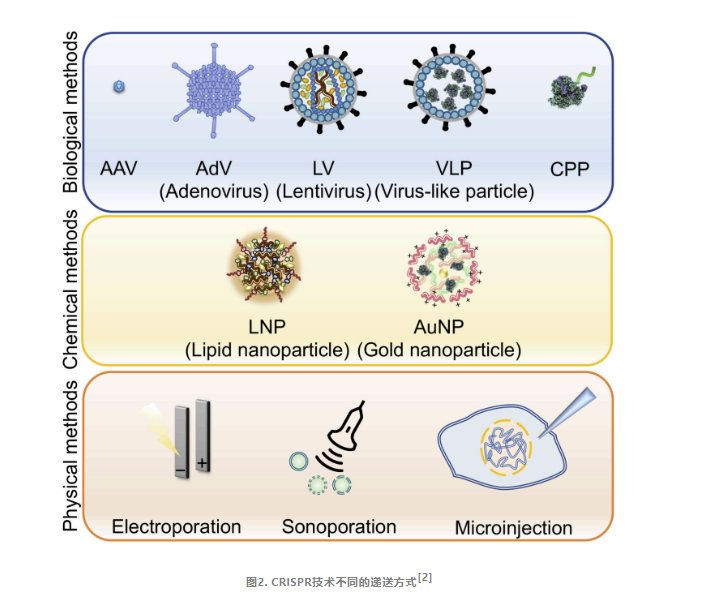
01
病毒载体
在CRISPR-Cas9系统中,病毒载体扮演着至关重要的角色。其中,AAV、慢病毒以及杆状病毒载体都是常用的递送工具。值得一提的是,AAV已经成为体内基因治疗领域最广泛应用的递送载体,并成功获得批准,递送CRISPR组件至人体用于疾病治疗。
AAV之所以备受青睐,源于它能够轻易地跨越物种屏障感染细胞,同时其免疫原性极低,大大降低了引发炎症反应的风险。然而,任何事物都有其局限性,AAV载体的最大包装容量仅为4.7kb,这对于体积庞大的CRISPR/Cas9基因编辑系统来说,无疑是一个巨大的挑战。尤其是当Cas9蛋白携带效应蛋白时,更是需要采取特殊的修改措施,如使用体积较小的SaCas9或将递送系统分割为两个载体,才能实现在AAV载体中的有效加载。
慢病毒作为能感染分裂和非分裂细胞的逆转录病毒,也常用作递送载体。由于慢病毒的10kb负载能力,整个CRISPR/Cas9系统都可以加载到其中,但慢病毒随机整合入宿主基因组可能引发免疫反应,甚至致癌。
02
脂质纳米颗粒(LNP)
尽管病毒载体递送系统已将CRISPR技术应用于临床,但其疗效仍受限于多重因素,如患者免疫反应、载荷大小限制、重复给药难度及长期基因表达等问题。因此,科研人员正积极探索新的递送策略,其中LNP-mRNA等非病毒系统备受瞩目。
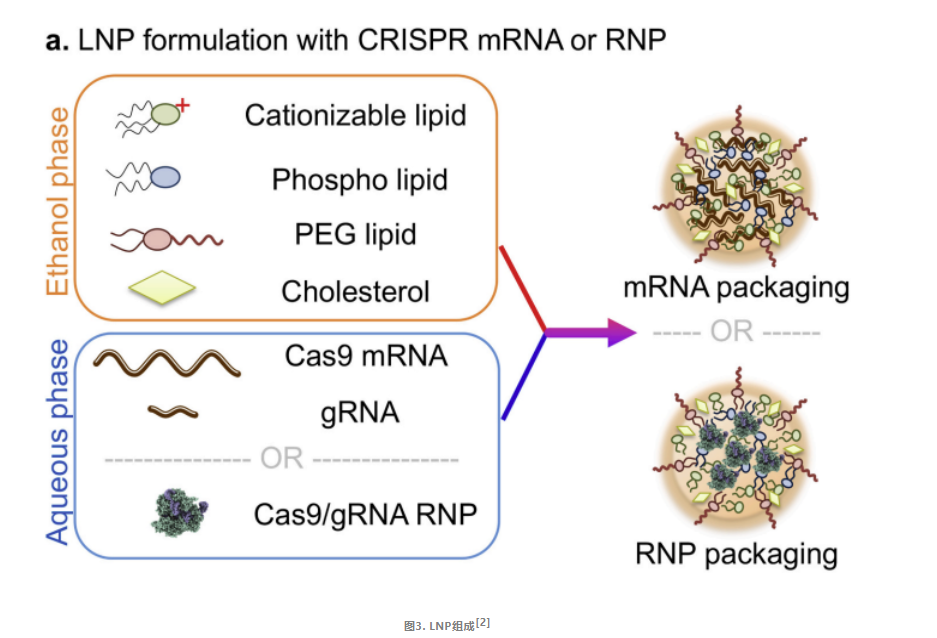
脂质载体是一种很有前景的CRISPR-Cas9系统递送载体,通常由四种脂类组成:阳离子型(或电离型)脂类、聚乙二醇脂类、辅助磷脂和胆固醇。LNP的核心技术在于其具有独特pH依赖性的阳离子化脂质。在递送阶段,这种脂质能够在中性pH环境下保持中性状态,与周围的成分和谐共处。然而,一旦进入酸性环境,如细胞内的内体,它便会迅速转变为阳离子状态。这种电荷状态的转变不仅能够诱导粒子解离,还能够破坏核内体膜,从而大大增强其从核内体逃逸的能力。这种机制不仅提高了递送效率,还有效地降低了全身毒性,使得LNP成为一种安全且高效的递送工具。
目前,已有多款基于LNP-RNA的疗法成功获得FDA的批准,这充分证明了LNP技术在实际应用中的可行性和有效性。
03
新兴递送系统
尽管LNP在临床实践中已展现出作为基因编辑纳米颗粒递送系统的先进性,然而,众多其他类型的纳米载体同样具备潜力,可巧妙地设计以进入细胞内部。例如,聚合物纳米颗粒、蛋白质衣壳递送系统以及类病毒颗粒(VLP)等,均为这一领域的研究者提供了新的递送策略。
在本文中,我们向您介绍了CRISPR/Cas系统的三种生物形式及递送方法,这些基础知识铺垫了对CRISPR技术的理解,为我们了解其在广泛领域应用奠定了基础。请继续关注我们的系列文章,在接下来的文章中,我们将带您了解CRISPR/Cas技术在细胞基因治疗、农业等不同领域中的应用,更多精彩内容,不容错过,敬请期待!
Cas RNP相关产品
|
产品分类 |
产品定位 |
产品名称 |
产品货号 |
|
Cas9蛋白 |
spCas9含核定位信号 |
Cas9 Nuclease |
14701ES |
|
spCas9+EGFP标签 |
NLS-Cas9-EGFP Nuclease |
11364ES |
|
|
dCas9,无切割活性 |
dCas9 Nuclease |
11351ES |
|
|
Cas12a蛋白 |
Agathobacter rectalis细菌来源 |
ArCas12a Nuclease |
14702ES |
|
氨基酸球菌来源 |
Ascpf1(Cas12) Nuclease |
11352ES |
|
|
新凶手弗朗西斯菌来源 |
Fncpf1(Cas12) Nuclease |
11353ES |
|
|
螺科菌来源 |
Lbcpf1(Cas12) Nuclease |
11354ES |
|
|
Cas12b蛋白 |
嗜酸耐热菌来源 |
AapCas12b Nuclease |
14808ES |
|
sgRNA合成 |
体外转录合成sgRNA |
Hifair® Precision sgRNA Synthesis Kit |
11355ES |
参考文献:
[1] Yi Lin, Ernst Wagner and Ulrich Lächelt, Non-viral delivery of the CRISPR/Cas system: DNA versus RNA versus RNP, Biomater. Sci., 2022, 10, 1166–1192
[2] Taha EA, Lee J, Hotta A. Delivery of CRISPR-Cas tools for in vivo genome editing therapy: Trends and challenges. J Control Release. 2022;342:345-361.
