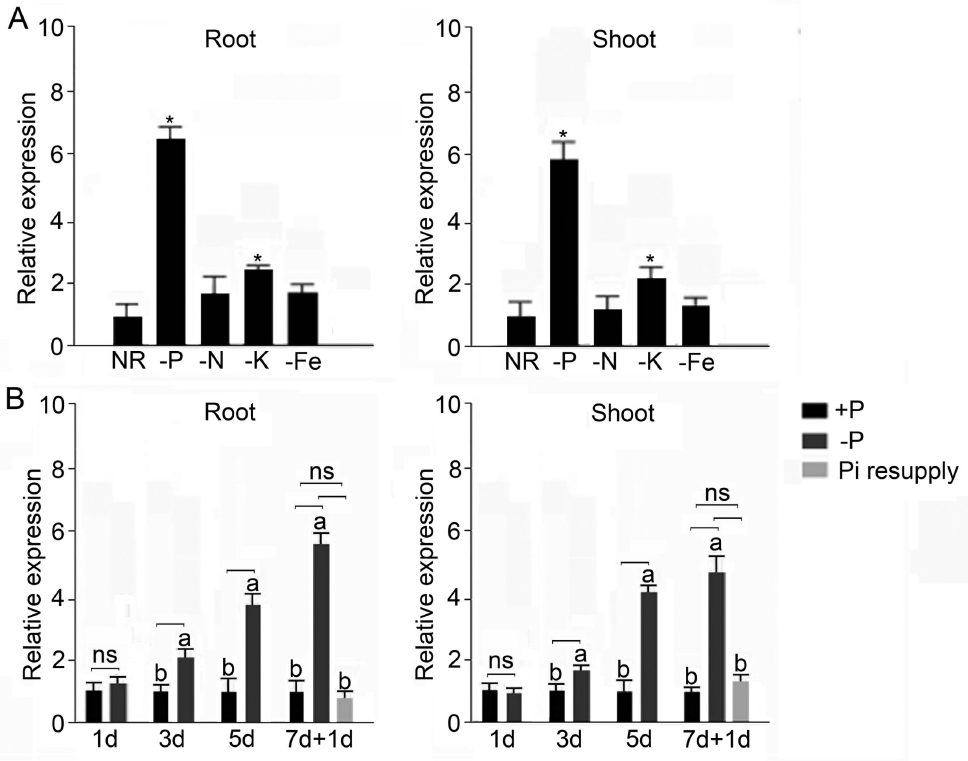
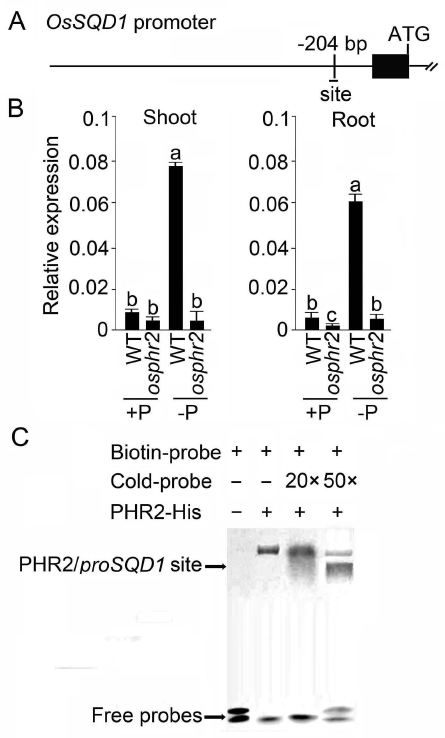
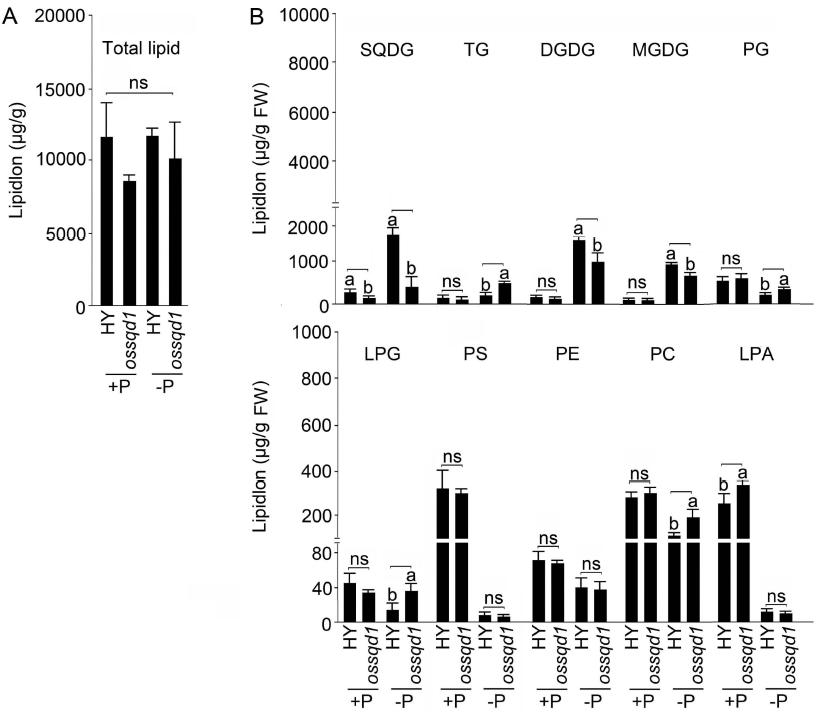
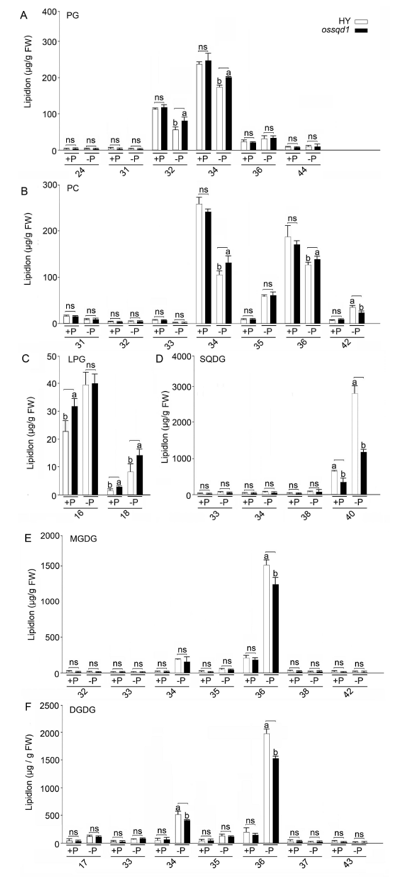
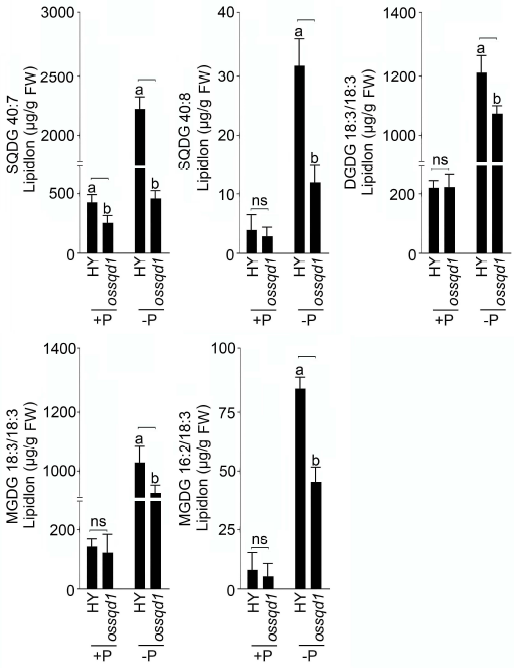
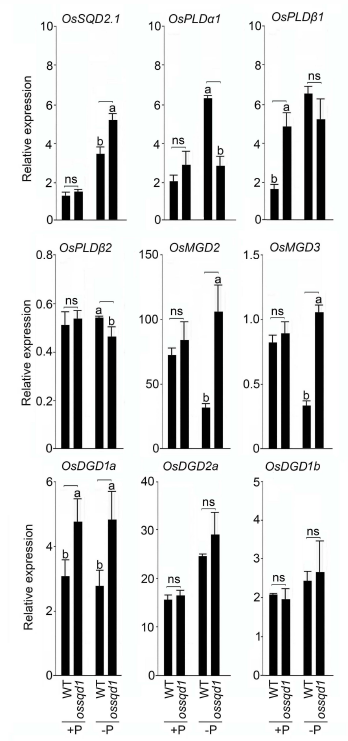
2021年6月24日,上海市农业科学院生态环境与植物保护研究所薛永课题组在Journal of Experimental Botany(IF=6.992)杂志上发表题为Silencing of Sulfoquinovosyl Diacylglycerol Synthase 1 Impairs the Glycolipids Accumulation and Photosynthesis in Phosphate-deprived Rice的研究成果。在水稻中,葡糖基二脂酰甘油合酶1(OsSQD1)是催化SQDG形成的关键酶。在这项研究中,作者发现OsSQD1受OsPHR2调节,OsPHR2是一种含有MYB结构域的转录因子。对OsSQD1基因敲除突变体的脂质组分析结果表明,OsSQD1基因沉默增加了磷脂含量,改变了Pi缺乏时的脂肪酸组成。此外,OsSQD1沉默可减少Pi缺乏条件下糖脂的积累。此外,OsSQD1沉默可通过下调水稻苗中的糖脂来抑制光合作用,特别是在缺磷条件下。研究表明,OsSQD1在磷脂代谢中起着关键作用,特别是在缺磷条件下糖脂的积累,从而抑制了光合作用对缺磷的响应。本项研究中中科新生命提供了脂质组绝对定量技术服务。 中科新生命脂质组组学产品优势 • 全脂质分子数据库(170万脂质分子) • 高分辨质谱平台,精确解析脂质分子 • 覆盖20+脂质亚类 • 同位素内标法绝对定量每种脂质分子含量/浓度 磷是细胞中必不可少的营养物质,在细胞功能和代谢中起着至关重要的作用。然而,由于许多土壤中磷的有效性有限,土壤中的磷浓度可能远低于植物组织和器官中的磷浓度从而导致磷的缺乏。为了缓解环境中的低磷胁迫,植物在形态、生理和分子生物学上发生了各种适应性变化。在低Pi条件下,植物可以通过改变或替换生物膜的结构和组成来释放或溶解可溶性P,以维持其在缺Pi条件下的基本生长发育。生物膜是许多不同类型脂质的混合物:鞘脂、甾醇和甘油脂等。甘油脂类有甘油主链,在sn-1和sn-2位置有两个脂肪酸分子,在sn-3位置有一个磷脂或糖脂分子。在高等植物中,磷脂主要包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酸(PA)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS)、磷脂酰甘油(PG)。在这些脂质类型中,PC和PE是主要的膜磷脂。糖脂包括单半乳糖二酰甘油(MGDG)、二半乳糖二酰甘油(DGDG)和磺基喹喔啉二酰甘油(SQDG)。这三种糖脂与PG一起构成质体膜。缺磷植物可通过非磷糖脂替代膜中的磷脂,利用膜上的磷脂作为内部磷供应的来源,这种机制会导致脂质组成发生重大变化。 水稻是世界上人口的主要食物之一。在发展中国家,大米提供了近30%的膳食能量供应。有研究表明OsSQD1的突变导致了缺磷时硫的上调和磷的下调。然而,OsSQD1对水稻幼苗缺磷时磷脂和糖脂稳态的影响尚不清楚。需要进一步研究来阐明不同Pi条件下OsSQD1对水稻光合作用的影响。在本研究中,作者使用OsSQD1突变体来分析不同的脂质种类和脂肪酸浓度,阐明了OsSQD1沉默导致Pi缺乏下磷脂的增加和糖脂的减少。此外,OsSQD1沉默还通过下调水稻芽中的糖脂抑制光合作用。本研究结果表明,OsSQD1在糖脂积累中起关键作用,这是影响光合作用对Pi缺乏反应的一个原因。 实验材料 WT水稻、knockout OsSQD1 mutant水稻 主要结果 1. OsSQD1位于OsPHR2的下游,对水稻中的Pi供应敏感 在氮、磷、钾缺失条件下,用qRT-PCR来测定OsSQD1的相对表达,结果表明磷供应对OsSQD1的相对表达诱导最显著,分别是根(提高6.8倍)和芽(提高6.2倍),缺钾条件下根和芽中的OsSQD1的相对表达也增加。氮和铁水平对根或芽中OsSQD1的相对表达都没有显著影响。这些结果表明,由于Pi缺乏,OsSQD1的相对表达显著增加。与其他营养缺乏的处理相比,这种增加是Pi缺乏所特有的。 为了检测OsSQD1的表达模式随缺Pi时间的变化,作者检测了OsSQD1在缺氧条件下不同时间点(1、3、5和7 d)的相对表达。结果发现当幼苗在-P处理3天和5天后,在根和芽中能观察到OsSQD1表达显著的增加。且OsSQD1的表达随处理时间的增加而增加。然而,在Pi再补给后的1 d内,OsSQD1的表达水平迅速下降至+P条件下的水平。这一结果表明,OsSQD1的相对表达对外部的Pi供应非常敏感。 图1 不同养分处理下OsSQD1的相对表达 OsSQD1可由Pi饥饿诱导转录,在OsSQD1的启动子区存在P1BS顺式元件,因此作者假设OsSQD1可能是由OsPHR2直接调节的下游基因。也在OsPHR2突变体中检测了OsSQD1的表达。在低磷条件下,茎和根中的OsPHR2突变下调了OsSQD1。此外,电泳迁移率偏移分析(EMSA)显示PHR2可以结合OsSQD1启动子区中的两个P1BS顺式元件。 图2 OsSQD1由OsPHR2调节 2. OsSQD1的沉默调节磷脂和糖脂在不同Pi状态下的浓度和组成 在前人的研究中已经发现植物脂质组成会因磷饥饿而发生变化,在本次研究中作者通过脂质组学方法进一步探究了不同Pi条件下OsSQD1突变体的脂质变化。结果表明,WT和OsSQD1突变体在脂质总量上没有差异。在+P条件下,OsSQD1突变体的TG、DGDG、MGDG、PG、LPG、PS、PE、PC和PE与WT水稻相比没有变化。在Pi缺乏时, OsSQD1沉默能显著降低DGDG和MGDG的浓度。此外,与WT相比,在-P条件下,OsSQD1突变体中TG、PG和PC的浓度显著增加。在+P和-P两种条件下,嫩枝中的SQDG浓度都显著降低。然而,在低磷条件下,OsSQD1突变体中的LPA浓度高于WT。 图3 脂质组学揭示OsSQD1的沉默后在+P和-P条件下的脂质变化 此外,不同磷条件下OsSQD1的沉默也影响不同脂质种类的脂肪酸浓度。在低磷条件下,32碳和34碳的PG浓度在突变体的芽中比野生型芽中高得多。然而,在Pi充足的芽中,它们没有被OsSQD1沉默所改变。在突变体中,34碳和42碳PC浓度分别降低了21.4%和10.8%,而36碳浓度分别增加了32.3%。对于糖脂,在+P和-P条件下,40碳SQDG都显著降低,导致突变体中SQDG的下调。 图4 OsSQD1的沉默改变了+P和-P条件下的脂质组成 3. OsSQD1沉默对脂质重构调控网络的影响 已经有多项研究表明,膜脂的分子多样性对细胞膜系统的稳态来说非常重要,所以脂肪酸饱和度一般与非生物胁迫耐受性有关,。因此作者在不同Pi条件下检测了WT和OsSQD1突变体芽中的脂肪酸饱和度。在+P条件下,OsSQD1的沉默显著降低了含1个不饱和键的PG的脂肪酸浓度。 图5 沉默OsSQD1可降低不同糖脂的脂肪酸浓度 通过脂质组对糖脂MGDG、SQDG和DGDG等不同脂肪酸的检测结果表明,在+P和-P条件下,与WT芽相比,SQDG (C40:7)的多不饱和脂肪酸在突变芽中显著减少。C40:8 SQDG的水平仅在Pi缺乏的条件下大大降低。此外,C18:3/18:3 DGDG、C18:3/18:3和C16:2/18:3 MGDG的浓度在仅在-P条件下沉默OsSQD1时降低。总之,这些结果表明,在不同的Pi条件下,特别是在Pi缺乏的条件下,OsSQD1的沉默改变了磷脂和糖脂中脂肪酸的饱和度。 4. 不同Pi机制下OsSQD1沉默对脂质重构调控网络的影响 作者又通过qRT-PCR检测了OsSQD1突变体中与脂质重构相关的几个基因,结果发现OsPLDα1(AK065102)、OsPLDβ1等的转录量因OsSQD1的沉默而显著增加,对其他基因的表达没有显著影响。当OsSQD1在-P条件下沉默时,OsPLDα1和OsPLDβ1的相对表达分别降低了68.3%和18.7%。另一方面,与WT相比,在Pi饥饿时,OsSQD2.1、OsMGD2、OsMGD3和OsDGD1a的转录本量在OsSQD1突变体的芽中上调。结果表明,在-P条件下,OsSQD1沉默对脂质重构的调节作用比+P条件下更强。OsSQD1沉默主要导致的是磷脂降解基因的下调和-P条件下糖脂合成相关基因转录量的上调。 图6 在+P和-P条件下生长的WT和OsSQD1突变中脂质合成相关基因的相对表达 总 结 在这项研究中,作者表明OsSQD1受OsPHR2调节,OsPHR2是Pi饥饿反应网络的中心转录因子。在缺磷条件下,OsSQD1的沉默改变了磷脂和糖脂的稳态,降低了糖脂的浓度,从而导致水稻叶绿素的减少和缺磷条件下光合作用的抑制。

研究背景

植物脂质组项目文章 | OsSQD1的沉默损害缺磷水稻的糖脂积累和光合作用
作者:上海中科新生命生物科技有限公司 2021-12-22T13:21 (访问量:3425)
上海中科新生命生物科技有限公司 商家主页
地 址: 上海市园美路58号1号楼15-18楼
联系人: 徐
电 话: 021-54665263
传 真:
Email:marketing@aptbiotech.com
相关咨询
会议邀请 | 第8届全国植物蛋白质研究大会暨首届贵阳生命科学新高地科学家论坛 (2023-07-07T14:37 浏览数:13760)
项目文章Cell(IF 64.5)| 中国科技大学探索食物过敏谜团 (2023-07-07T14:22 浏览数:13920)
Gastroenterology(IF 29.4)| 基于机器学习算法开发的外泌体miRNA生物标志物用于胰腺导管腺癌早期诊断 (2023-07-05T15:54 浏览数:11549)
Cancer Letters(IF 9.7)|天津市环湖医院利用Labelfree揭示超声-替莫唑胺联合诱导胶质瘤细胞的凋亡机制 (2023-06-30T09:37 浏览数:12583)
Excel表免费下载 | 速来围观!2023年影响因子发布 (2023-06-29T09:35 浏览数:11340)
外泌体多组学创新解决方案,精准、前沿的疾病诊断生物标志物 (2023-06-28T10:20 浏览数:15533)
Immunity (IF=43.474)丨单细胞+空间联合揭示肉芽肿形成的异常淋巴发育进程 (2023-06-26T17:28 浏览数:11700)
专家齐聚 亮点回顾 | 2023年海口·中医药创新多组学研究论坛圆满落幕 (2023-06-25T10:10 浏览数:16248)
项目文章Plant J(IF 7)| 杭州师范大学王慧中团队通过空间代谢+单细胞测序等揭示红豆杉幼茎细胞特异的紫杉烷合成调控模式 (2023-06-25T09:42 浏览数:13825)
项目文章Gut Microbes(IF 9.434)| 肠道微生物竟是导致胆囊切除术后患者腹泻的元凶? (2023-06-14T16:35 浏览数:11244)
